
2022年8月31日,浙江大学医学院附属第一医院(以下简称浙大一院)和浙江大学血液学研究所黄河教授团队等开展的临床研究成果在国际顶级期刊Nature以论著形式在线发表(Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL, CRISPR/Cas 介导的非病毒定点整合CAR-T 细胞治疗复发/难治性 B 细胞非霍奇金淋巴瘤具有高安全性及有效性)。浙大一院胡永仙主任医师等为论文共同第一作者,黄河教授为第一通讯作者,邦耀生物/华东师范大学刘明耀教授为共同通讯作者,其团队成员张楫钦为第一作者。
全球首次研制新型CAR-T细胞产品
CRISPR/Cas9介导的非病毒定点整合CAR-T细胞是目前国际细胞免疫治疗领域最具有挑战性的全新技术。以往CAR-T细胞制备是采用患者本身的淋巴细胞在体外通过病毒转染的方法,将针对肿瘤靶点的CAR分子整合到T淋巴细胞中,形成CAR-T细胞。在美国已经有6个CAR-T细胞产品上市,其中5个为针对CD19靶点,1个针对BCMA多发性骨髓瘤靶点,商业价格约为250万人民币/例。在中国已上市2款针对难治复发淋巴瘤的CD19靶点CAR-T产品,治疗价格分别为120万/例和129万/例。这些CAR-T产品的上市,为难治复发恶性淋巴瘤患者带来了生的希望,成为恶性肿瘤治疗领域最具有突破性的技术。
传统的CAR-T产品还存在着一些亟待突破的问题:(1)用病毒转染方法制备CAR-T细胞存在着靶点随机插入导致CAR-T细胞质量良莠不齐;(2)随机插入基因片段有导致肿瘤基因改变的风险;(3)目前的CAR-T细胞产品对难治复发淋巴瘤的完全缓解率约为50%左右,疗效还有待提高;(4)淋巴瘤治疗中由于肿瘤细胞的快速杀灭和细胞因子释放而导致全身的严重反应,在临床上被称为细胞因子释放综合征和免疫效应细胞相关的神经毒性综合征。全球的科研工作者努力研发非病毒定点靶向基因转导技术,从而消除目前CAR-T制备方法存在的不足,并进一步对免疫细胞中的关键基因进行改造,达到更好的疗效和更低的毒副反应。
CRISPR/Cas9介导的非病毒定点整合CAR-T细胞技术可以有效解决使用病毒载体带来的几大难题,展现出了巨大的优势。定点整合可以让每个CAR序列都精确地插入到基因组的特定位点,能避免随机插入导致的致瘤风险,最大程度保证了CAR-T产品的安全性和有效性。只需一步制备,即可同时实现CAR的持续性表达和T细胞内源基因的调控,大大缩短了整个CAR-T产品的制备时间,得以让更多患者受益。另外,使用非病毒生产工艺还可以极大减少因使用病毒载体带来的高昂成本。
浙大一院黄河教授团队与邦耀生物刘明耀教授团队合作,利用2020年获诺贝尔奖的CRISPR/Cas9基因编辑技术对T淋巴细胞中PD1位点精确敲除,定点插入针对肿瘤细胞的靶向CD19 CAR分子,构建完成全新的非病毒定点整合CAR-T细胞(PD1-19bbz),并首次在人体内完成Ⅰ期临床研究,验证了新型CAR-T细胞的安全性及有效性。
这是全球首次利用CRISPR/Cas9基因编辑技术在PD1位点实现定点整合的CAR-T细胞产品,也是世界首例非病毒PD1定点整合CAR-T细胞治疗淋巴瘤的临床研究。研究结果表明,使用同源臂长度为800bp的线性双链DNA作为模板可以通过同源介导修复(HDR)机制获得数量最多的CAR整合细胞;PD1-19bbz CAR-T细胞无论在PD-L1高表达还是低表达的肿瘤细胞中,都体现出更强大、更持久的杀伤效果,小鼠生存率得到显著提高;进一步开展临床研究表明:在接受治疗患者中未观察到CAR-T治疗相关的神经毒性和2级以上的细胞因子释放综合征,证明PD1-19bbz CAR-T细胞具有出色的临床安全性。用PCR技术和流式细胞术方法检测发现PD1-19bbz CAR-T细胞在患者体内可获得快速扩增和长时间的维持。在难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%。进一步单细胞测序研究结果表明,PD1-19bbz CAR-T细胞产品中存在高比例的记忆性T细胞,体内PD1-19bbz CAR-T细胞具有更强的杀伤肿瘤作用,长期存续的CAR-T细胞具有记忆性细胞的特征。全面阐明了非病毒PD1定点整合CAR-T细胞优越的临床疗效背后的作用机制。
这项工作的成功意味着全新CAR-T细胞技术平台的建立,也是迄今为止全球CAR-T细胞治疗难治复发淋巴瘤中高缓解率和低毒副反应的最好临床结果。标志着中国学者在CAR-T细胞研发及临床转化应用领域处于国际领先地位。


世界首例非传统CAR-T细胞治疗淋巴瘤临床研究
化疗14次,放疗20次,全胃切除.....从2018年到2020年,整整两年,40岁的广州孙先生(化名)全国求医,吃尽苦头,依旧打败不了肿瘤界的“变色龙”——弥漫大B细胞淋巴瘤,这是成人淋巴瘤中最常见的一种类型。他想看到儿子上大学的愿望是否还能实现?“很难,做好心理准备吧。”2020年3月,很多家大医院告诉他,他的腹腔内多发淋巴瘤病灶且侵犯了肠壁,多次的放化疗依旧阻挡不了爱打“游击战”的淋巴瘤,四处求医,四处碰壁,看似现代医学已经奈何不了它了。可孙先生的儿子高考还要两年,他不甘心,他要继续与淋巴瘤“战斗”,他要跟时间赛跑,“只要活着看到孩子上大学,死了也能闭眼了。”为求最后一线生机,他来到杭州求医。这一次,医生告诉他,“我们一起搏一把。”
当2020年孙先生来到杭州求医时,腹腔内多发淋巴瘤病灶,且淋巴瘤侵犯肠壁。黄河团队研究认为,淋巴瘤侵犯肠壁是CAR-T治疗的相对禁忌症,在接受CAR-T细胞治疗时容易发生肠穿孔,因此,孙先生已不再适合接受传统的CAR-T细胞治疗,而全新的PD1-19bbz CAR-T细胞,发生细胞因子风暴和其他并发症的发生风险低,“这或许可以给病人一个生还的机会。”
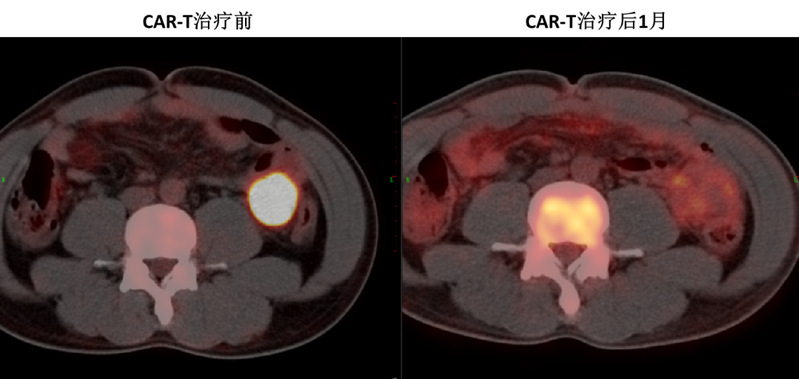
在完成各项临床研究报批后,2020年5月26日,浙大团队为孙先生输注PD1-19bbz CAR-T细胞,回输后的6月9日,孙先生CAR-T细胞回输后14天各项指标正常,经评估后出院,在回输后1个月进行PET-CT评估,结果显示原腹腔侵犯肠道粘膜部位的大包块肿瘤已完全消失。如今孙先生无病生存已超过2年。
团队进一步开展临床研究,结果表明,在接受治疗患者中未观察到CAR-T治疗相关的神经毒性和2级以上的细胞因子释放综合征,证明PD1-19bbz CAR-T细胞具有出色的临床安全性。用PCR技术和流式细胞术方法检测发现PD1-19bbz CAR-T细胞在患者体内可获得快速扩增和长时间的维持。
在难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%。进一步利用单细胞测序技术研究PD1-19bbz CAR-T细胞体内作用机制,结果表明PD1-19bbz CAR-T细胞产品中存在高比例的记忆性T细胞,体内PD1-19bbz CAR-T细胞具有更强的杀伤肿瘤作用,长期存续的CAR-T细胞具有记忆性细胞的特征。这也全面阐明了非病毒PD1定点整合CAR-T细胞优越的临床疗效背后的作用机制。
在最近的一次随访中,孙先生的所有检查项目均达标,体重也比患病前增加了不少,脸色看起来也更红润了。“经过细胞治疗后身体感觉一下子就恢复正常了,亲朋好友也都说我是奇迹般地康复了,现在闲暇时还会去打打羽毛球,完全恢复了患病前的生活状态。感谢新型CAR-T细胞疗法,让我还能看到儿子上大学。感谢浙大一院黄河院长团队的精心治疗,帮助我战胜病魔,获得重生。” 时隔两年,2022年夏天,孙先生给杭州的医护人员们分享了好消息:儿子确定被清华大学美术学院录取!




