系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)是一种复杂的慢性自身免疫性疾病,其特征是产生大量自身抗体,攻击多个器官系统,导致临床表现多样且病情反复,严重影响患者生活质量。尽管现有治疗手段不断进步,但仍有部分患者对常规免疫抑制疗法反应不佳,成为难治性系统性红斑狼疮(rSLE),亟需创新的治疗策略。
近年来,嵌合抗原受体T细胞(CAR-T)疗法在血液肿瘤治疗中取得了革命性突破,其在自身免疫病领域的应用潜力也备受关注。此前已有研究报道了靶向CD19的CAR-T疗法在SLE治疗中的初步成效,但其靶点选择的理论依据、双靶点治疗的必要性以及能否彻底清除致病性抗体克隆等关键问题仍有待深入探索。
2025年9月24日,浙江大学医学院附属第一医院黄河教授、胡永仙教授与刘志红院士、鲁林荣教授及林进主任课题组合作在Nature Medicine上发表了题为Co-infusion of CD19-targeting and BCMA-targeting CAR-T cells for treatment-refractory systemic lupus erythematosus: a phase 1 trial的研究论文。该研究是迄今为止报道的样本量最大的CAR-T细胞治疗SLE的临床研究。研究团队通过I期临床试验证明,联合输注靶向CD19和BCMA的双靶点CAR-T细胞治疗难治性SLE是安全且高效的。研究首次结合单细胞BCR测序与抗体表达纯化验证技术,发现致病性自身抗体可来源于两类长期存活的细胞:CD19⁺BCMA⁻记忆B细胞和CD19⁻BCMA⁺长寿浆细胞,为采用双靶点联合治疗提供了关键的理论依据。更重要的是,长达近两年的随访结果显示,该疗法能够持久清除致病性B细胞克隆,重塑健康的体液免疫系统,显示出实现“功能性治愈”的巨大潜力。

首次揭示:SLE 致病抗体的“双工厂”来源
为了明确SLE中致病性自身抗体的精确来源,研究团队对部分难治性SLE患者的外周血记忆B细胞和骨髓长寿浆细胞进行了单细胞BCR测序。通过克隆和体外表达优势抗体,证实了CD19⁺ B细胞和CD19⁻BCMA⁺长寿浆细胞均是产生自身抗体的重要来源。这一发现提示,同时靶向B细胞(CD19)和浆细胞(BCMA)的双靶点策略对于更彻底地清除致病细胞至关重要。
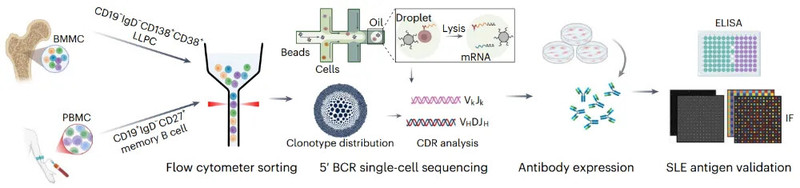
双靶向临床研究:安全、高效、未见复发
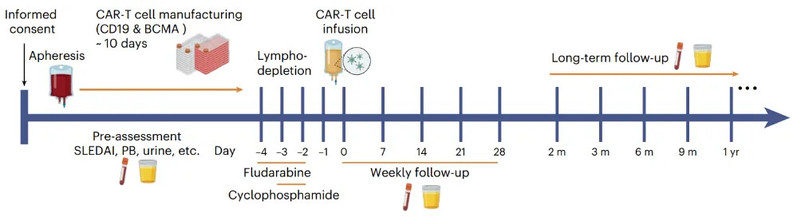
基于这一关键发现,团队开展了一项I期、剂量爬坡的临床试验,共纳入15名难治性SLE患者。这些患者在接受氟达拉滨/环磷酰胺的淋巴细胞清除预处理后,回输了自体抗CD19和抗BCMA的CAR-T细胞。
在安全性方面,该疗法表现出良好的耐受性。在中位712天的随访期内,未发生剂量限制性毒性(DLT)和治疗相关死亡。86.7%的患者出现了1级细胞因子释放综合征(CRS),无神经毒性事件发生。最常见的3级及以上不良事件为血液学毒性,如中性粒细胞减少症(100%),但均为可逆的,经支持性治疗后均可恢复。
在临床疗效方面,结果令人振奋。在CAR-T细胞输注后的第12周,15名患者中有12名(80%)达到了狼疮低疾病活动度状态(LLDAS)和DORIS缓解标准。所有患者的SLE相关症状均持续改善,疾病活动指数(SLEDAI-2K)显著下降。此外,患者的自身抗体(如抗dsDNA抗体)水平显著降低,补体水平恢复正常,蛋白尿等器官损伤指标也得到明显改善。截至论文撰写时,所有患者均未复发。
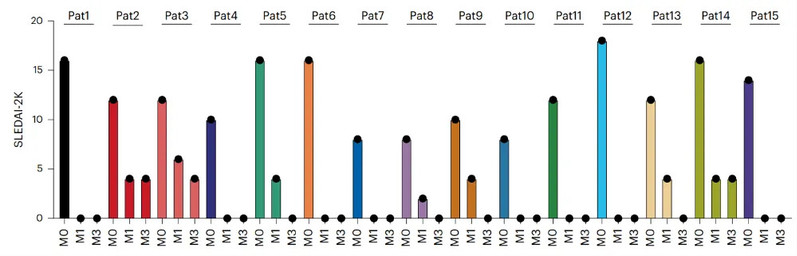
机制亮点:彻底消除致病克隆,达到免疫重置
研究团队进一步利用多组学技术证实,双靶点CAR-T疗法有效清除了产生自身抗体的B细胞和浆细胞克隆。在治疗后,患者的免疫系统得以重建,新生的B细胞主要为初始的IgM/IgD型B细胞,表明免疫系统向更健康的状态“重置”。同时,与SLE疾病活动密切相关的干扰素刺激基因(ISG)和BAFF依赖信号通路被持久下调,免疫稳态得到改善。
尤为关键的是,通过对部分患者长达一年的纵向单细胞BCR追踪分析,研究团队发现,治疗前存在的致病性B细胞克隆在治疗后被完全清除,并且在免疫重建过程中没有再次出现,这为该疗法可能带来的长期缓解甚至治愈效果提供了强有力的分子证据。
浙江大学医学院附属第一医院主治医师冯晶晶、特聘研究员霍大伟、主治医师洪睿敏,浙江大学医学院附属邵逸夫医院助理研究员金雪潇,浙江大学医学院附属第一医院主任医师曹恒、住院医师邵谧、博士研究生温睿为该论文的共同第一作者。黄河教授、胡永仙教授、林进主任、鲁林荣教授、刘志红院士、张鸿声教授为该论文共同通讯作者。
原文链接:

