肿瘤免疫疗法的快速发展推动了多种免疫细胞重定向策略的出现,通过工程化手段将T细胞或自然杀伤(NK)细胞引导至肿瘤靶点已成为细胞免疫疗法的重要实现方式。嵌合抗原受体T(CAR-T)细胞已在血液系统恶性肿瘤中获得显著疗效,但仍面临生产成本高昂、自体细胞依赖、毒副作用风险、肿瘤免疫逃逸等障碍。相较之下,CAR-NK细胞在可及性和安全性上具有明显优势,但其体内持久抗肿瘤效能对比具有免疫记忆效应的T细胞仍显不足。与此同时,另一类策略则通过特定抗体,尤其是双特异性细胞接合器(如BiTE、BiKE)激活并重定向非工程化的免疫效应细胞,引导内源T细胞或NK细胞攻击肿瘤。这类蛋白质药物无需对体内细胞进行工程化改造,但因其短半衰期需要持续注射,在总体治疗成本上相较过继性细胞疗法并无优势。在此背景下,如何设计一种可同时发挥CAR-T细胞靶向稳定性和双抗协同激活优势的新型系统,成为免疫治疗领域的重要课题。现有研究中尚缺乏一种统一策略,既能精准控制肿瘤靶向,又可扩大免疫反应范围,并在保证安全性的基础上激活多类免疫细胞。针对这些挑战,研究者正在积极探索融合性细胞平台,以期实现治疗效果与操作可行性的平衡。
近日,来自浙江大学医学院附属第一医院骨髓移植中心/良渚实验室孙洁/黄河团队的樊雅博士等人在Nature Biomedical Engineering杂志发表了题为Bispecific killer cell engager-secreting CAR-T cells redirect natural killer specificity to enhance antitumour responses的研究论文,系统性对比了多种基于嵌合抗原受体与分泌型双特异性免疫细胞接合器的T/NK细胞联合应用形式,开发出具备优秀效能与肿瘤抗原异质性应对能力的BiKE分泌型CAR-T细胞与NK细胞联合治疗策略。

研究团队提出了一种新型的工程化细胞平台,在传统CAR-T细胞基础上整合分泌型双特异性NK细胞接合器(BiKE),可在体内持续重定向NK细胞,从而显著增强整体抗肿瘤效能。该策略实现了 T 细胞与 NK 细胞的联合作战,在多个肿瘤模型中显示出更强的抗癌效果和更广的适应范围,尤其在处理肿瘤抗原异质性表达或效应细胞剂量受限等现实条件下优势更加明显。在具体设计中,研究者构建了一种双顺反子表达载体,使 CAR-T 细胞同时表达嵌合抗原受体(CAR)和一种新型 BiKE 分子。BiKE 是一种桥接抗体,一端结合肿瘤抗原(如 CD19 或 EGFR),另一端识别 NK 细胞表面的 CD16a 受体。通过这种方式,CAR-T 细胞除了本身具备识别和杀伤肿瘤的能力,还能持续分泌 BiKE 激活周围未经改造的 NK 细胞,调动固有免疫资源,形成“主动杀伤 + 协同激活”的免疫合力(图1)。这种设计不仅提高了细胞治疗的效力,也拓展了免疫应答的范围。
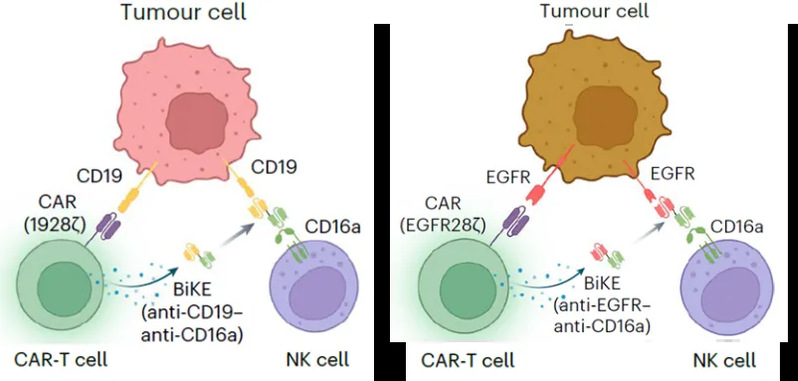
在体外实验中,研究团队首先证实了CAR-T细胞分泌的BiKE 分子能够激活自体或异体来源的 NK 细胞,显著增强其对肿瘤细胞的识别和杀伤能力。接下来,在CD19+ B细胞急性白血病模型中对该策略进行了验证并与BiTE分泌型CAR-NK细胞联合T细胞的策略进行了比较。结果表明,同样与NK细胞联用,BiKE分泌型CAR-T细胞在相同剂量、特别是低剂量条件下对肿瘤的抑制作用显著优于传统 CAR-T 细胞。一次CAR-T细胞输注联合定期NK细胞输注即可实现长期完全缓解效果。而作为对比,BiTE分泌型CAR-NK细胞联合T细胞仅能达到一过性肿瘤抑制,复发很快出现且重复输注T细胞无效。接下来,类似的疗效优势在EGFR+卵巢癌模型中得到了进一步的印证。以此为基础,研究者模拟了抗原表达异质性场景,发现使用靶向单一抗原的传统 CAR-T 细胞与无特定抗原靶向性的NK细胞无法完全清除肿瘤细胞,而在联合 BiKE 功能后,NK 细胞被显著激活,能够识别并杀伤具有抗原异质性的肿瘤亚群,整体抗肿瘤效果得到提升(图2)。组织分析和体内成像结果显示,CAR-T-BiKE 组的 NK 细胞浸润明显增强,表现出更强的杀伤活性,验证了该策略能够有效应对肿瘤抗原异质性导致的免疫逃逸。
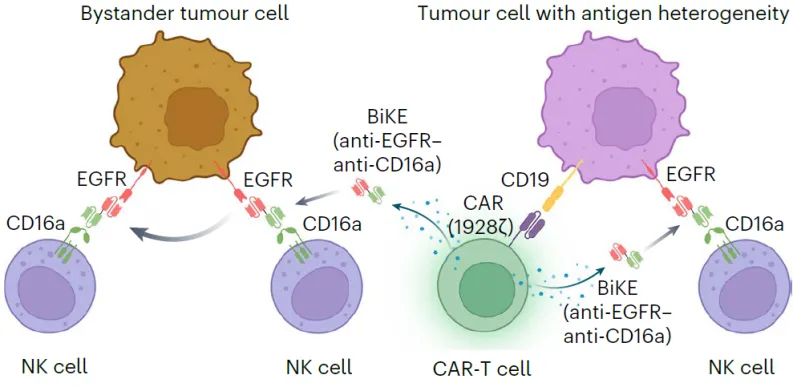
这些发现说明,该平台无需同时制备多种工程化细胞,而是以 CAR-T 细胞为“核心工厂”,同时释放可以激活其他免疫效应细胞的关键因子,在保持治疗精准性的同时,显著扩大免疫响应范围,提升疗效并可能降低治疗所需剂量,从而有助于降低细胞治疗的整体成本。此外,相较于传统双抗蛋白直接注射,该系统依托细胞持续释放免疫细胞接合器,有望减少体内蛋白降解、频繁给药和系统毒性等问题,提高治疗的安全性。这一研究展示了细胞工程与免疫调控结合的新范式,通过让CAR-T 细胞承担“杀伤 + 激活”双重功能,实现了对抗肿瘤免疫环境更全面的调动。未来在临床转化中,该平台有望降低细胞治疗门槛,并为下一代多功能免疫治疗产品开发提供技术基础。
原文链接:
https://www.nature.com/articles/s41551-025-01450-4

